Die Größen der Technik
<< zur NamenslisteMichael Faraday
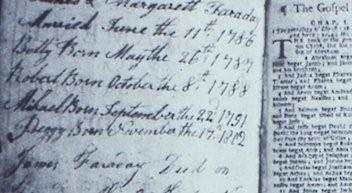
Quelle: Homepage der Royal Institution.
Die Eltern James Faraday und Margareth Hastwell heiraten am 11. Juni 1786, im Jahr drauf kommt Betty, im nächsten Robert auf die Welt. Michael wird am 22. September 1791 geboren, und als Nachzügler folgt 11 Jahre später Peggy. Michael kommt in Newington Butts, Southwark, zur Welt, das ist kein sehr renommierter Londoner Vorort - viel Gesindel und arme Menschen leben da. Die Eltern haben sich wenige Monate vor Michaels Geburt wegen der besseren Berufsaussichten des Vaters, eines Schmieds, aus Yorkshire im Norden Englands dort niedergelassen. Wenige Jahre später wohnen sie in einem Londoner Hinterhaus über einer Garage, eine gängige Wohnsituation im London des 19. Jahrhunderts – wenn auch nicht für Personen, die später zu den führenden Wissenschaftlern ihrer Zeit gehören werden. Die Familie gehört der kleinen christlichen Glaubensgemeinschaft der Sandemanianer an, die vom Schwiegersohn des eigentlichen Religionsstifters, dem Schotten John Glas, nämlich Robert Sandeman, im Frühjahr 1762 nach London gebracht wurde und in England und Amerika nach ihm benannt ist. Das Elternhaus von Michael dient auch als Versammlungshaus, und Michael versieht zwischen 1830 und 1864 immer wieder das Amt eines Diakons.
Die Biographen sind sich einig, dass dieses Glaubensbekenntnis Faraday stark in der Herangehensweise seiner Forschungsarbeit beeinflusst, weil die Sandemanianer neben der Bedeutung der Schrift und der Wahrheit der Bibel auch die Gemeinschaft der frühen Christen und den Glauben an eine Einheit der Welt für sehr wichtig halten. Faraday, der sich der Qualität seiner Arbeit und seiner außergewöhnlichen geistigen Fähigkeiten bewusst ist, nimmt dies als Geschenk, nicht als Verdienst. Dies dürfte auch der Grund sein, dass er keine seiner Beobachtungen und Entdeckungen jemals patentieren lässt, was ihn im Handumdrehen zu einem steinreichen Mann gemacht haben würde – eine Gelegenheit, die Werner von Siemens eine Generation nach ihm ergreift, als er seine auf Faradays Gedankengängen basierende Dynamomaschine zum Patent anmeldet und damit den Grundstein zu seinem Industrieimperium legt. Faraday hingegen ist der Ansicht, dass alles von ihm Beobachtete auf den Naturgesetzen beruht, die Gott allen Menschen gleich zur Nutzung übergeben hat.
Der junge Michael genießt nur eine schulische Basisausbildung im Trivium (Lesen, Schreiben, Rechnen) und beginnt mit 12 Jahren als Laufbursche in der Buchbinderei des hugenottischen Auswanderers George Ribeau, wo er dann mit 14 eine Lehre antreten kann, die sieben Jahre dauert und ihm Gelegenheit gibt, alle Bücher förmlich in sich hineinzufressen, die von ihm und den Kollegen gebunden werden. Denn nach Feierabend darf er die Bücher der angeschlossenen Buchhandlung lesen. So eignet er sich autodidaktisch eine naturwissenschaftliche Bildung an, die in erster Linie von der exakten Denkweise in Isaac Watts´ The Improvement of the Mind geprägt ist. Dort wird empfohlen, von Gelesenem Notizen zu machen, von Gehörtem Mitschriften anzufertigen, und sich mit Gleichgesinnten auszutauschen. Daraufhin schließt sich der Buchbinderlehrling einer philosophischen Gesellschaft junger Leute an, der City Philosophical Society, und tauscht mit seinen Freunden lange Briefe aus, um seinen Ausdruck zu verbessern.
Faraday führt Zeit seines Lebens eine ausgedehnte Korrespondenz, von der nahezu 4.900 Briefe erhalten sind. Seit 1991 betätigt sich Frank James von der Royal Institution als Editor einer geplanten Gesamtausgabe in sechs Bänden, von der bis 2008 fünf Bände erschienen sind.

1812 ermöglicht ihm ein Kunde den Besuch der letzten Vorlesungen von Sir Humphrey Davy in der Royal Institution. Davy hat mit seinen Untersuchungen über Lachgas einen großen Bekanntheitsgrad errungen und hält öffentliche Vorträge für die feine Londoner Gesellschaft. Ihm gelingen mittels einer Voltasäule eine Reihe von Schmelzflusselektrolysen, mit denen er die Elemente Kalium und Natrium isoliert. Er nennt sie Potassium, weil er Kaliumhydroxid aus Pottasche dazu verwendet, und Sodium, weil er dieses Metall durch die Elektrolyse von Soda gewinnt). 1812 wird Davy von König Georg III. in den Adelsstand erhoben und heiratet die reiche Erbin Jane Apreece. Er legt daher seine Erwerbstätigkeit in der Royal Institution nieder, behält sich jedoch vor, das Labor weiterhin nutzen zu dürfen. Faraday ist so angetan von seinem Vortrag, dass er seine Notizen überarbeitet, illustriert und zu einem netten Büchlein bindet (er ist ja Buchbinder), welches er Davy mit dem Gesuch um Aufnahme in seine Dienste zukommen lässt. Das trifft sich gut, denn Davy ist soeben aufgrund einer Schlägerei unter Kollegen ein Mitarbeiter abhanden gekommen, den er ersetzen muss, und außerdem plant er einen zweijährigen Aufenthalt auf dem Kontinent, bei dem er eine fähige Reisebegleitung brauchen kann.
Diese Reise ist deshalb bemerkenswert, weil sie Engländer, die seit 1806 durch die von Napoléon verhängte Kontinentalsperre wirtschaftlich völlig isoliert sind, durch jenes Land führt, welches für diese mit schweren wirtschaftlichen Einbußen verbundene Maßnahme verantwortlich ist. Man reist also nach Paris und besucht dort unter anderen Wissenschaftlern auch André-Marie Ampère und stattet in Italien Alessandro Volta einen Besuch ab. Diese Reise ist für den aus ärmlichem und ungebildetem Elternhaus stammenden Michael ein ausgesprochener Glücksfall, denn erstens lernt er in dieser Zeit französisch und italienisch, und zweitens hat er die Gelegenheit, auf ungewöhnlichem Wege universitäre Bildung nachzuholen, denn man besucht viele chemische Labors, und durch seinen international renommierten Dienstherrn als Reisegefährten erhält auch der junge Faraday ungehinderten Zutritt zu den wissenschaftlichen Errungenschaften seiner Zeit, präsentiert von erfahrenen Gelehrten.
Wieder zurück in London, nimmt Faraday seine Arbeit als Gehilfe im Laboratorium der Royal Institution wieder auf: Zusätzlich zur Wartung der Versuchsapparaturen wird ihm die Verantwortung für die mineralogische Sammlung übertragen. In der Freizeit darf er die Laborgeräte für eigene Experimente benutzen und veröffentlicht 1816 sein erstes wissenschaftliches Papier über toskanischen Ätzkalk. In der Philosophischen Gesellschaft hält er bereits gelegentlich Vorträge über Chemie.
1821 ist ein wichtiges Jahr für den mittlerweile Dreißigjährigen: Erstens wird er zum „Superintendent of the House“ der Royal Institution ernannt, nachdem seine Veröffentlichung über die beiden von ihm entdeckten Chlorkohlenstoffverbindungen C2Cl4 und C2Cl6 vor der Royal Society verlesen wurden, und dann wird geheiratet, nämlich Sarah Barnard, deren Familie ebenfalls in der Sandemanianergemeinde sehr engagiert ist. Die Ehe bleibt kinderlos - das könnte ebenso wie Faradays späterer schlechter Gedächtniszustand mit dem Hantieren mit Quecksilber als Chemielaborant zu tun haben. Im Zusammenhang mit der Hochzeit dürfte auch seine Übersiedelung in eine Dienstwohnung der Royal Institution stehen.
Unabhängig davon aber beginnt er sich in diesem Jahr mit dem Zusammenhang von Elektrizität und Magnetismus zu beschäftigen. Elektrizität war ja auch schon auf der Europareise ein großes Thema in der Auswahl der Laborbesuche. Der Däne Hans Christian Oersted hat erst im Jahr zuvor unter Zuhilfenahme eines Kompass´ entdeckt, dass sich ein magnetisches Feld aufbaut, wenn Strom durch einen Leiter fließt. Im Herbst wird Faraday aufgefordert, den Stand der diesbezüglichen Forschungen in einem zusammenfassenden Artikel für die Annals of Philosophy zu beschreiben, und erweitert die in seinem eigenen Labor wiederholten Versuche Oersteds in einer Art und Weise, die ihn zur Entdeckung der elektromagnetischen Rotation führt: Ein stromdurchflossener Leiter dreht sich unter der Einwirkung eines ihn umringenden magnetischen Feldes um sich selbst – das Prinzip des Elektromotors.
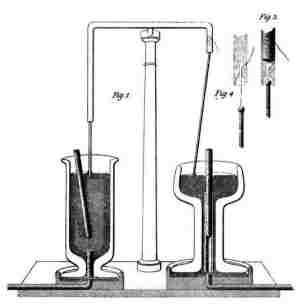
Diese Skizze der elektromagnetischen Rotation stammt von Michael Faraday, 1844
Dennoch ist das Jahrzehnt zwischen 1821 und 1831 in erster Linie der Chemie gewidmet. Als Labordirektor ist er in seinen Analysen und Forschungen thematisch an die Auftragsarbeiten gebunden, die das Labor der Royal Institution für unterschiedlichste zivile und auch militärische Auftraggeber übernimmt – vom Bergbau über die Stahlproduktion bis hin zu optischen Gläsern. Die beiden wichtigsten Arbeiten Faradays betreffen 1823 das flüssige Chlor und 1825 das Benzol. Bei der Beschäftigung mit Chlor, das von seinem Lehrer Davy als Element entdeckt worden ist, gelingt es ihm nachzuweisen, dass sich gasförmiges Chlor bei großer Kühlung und unter hohem Druck verflüssigen lässt. In der Folge weist er an einer Reihe weiterer Stoffe nach, dass die Aggregatszustände fest, flüssig und gasförmig nicht nur bei Wasser keine festen Kategorien bilden, sondern durch Änderung von Druck und Temperatur ineinander überführbar sind.
1824 wird Faraday zum Fellow der Royal Society gewählt, ein von der Optik her schwieriges Unterfangen, weil sein Förderer Davy gerade Vorsitzender ist und auf gar keinen Fall möchte, dass das nach Protektion aussieht, und außerdem: Wie sieht das aus, wenn sein eigener Assistent als Mitglied ihm plötzlich quasi gleichgestellt ist. Davy wird von den anderen Mitgliedern überstimmt, und Faraday erwähnt die Sache mit keinem Wort.

Die bundesdeutsche Briefmarke erschien zum 100-Jahr-Jubiläum der Strukturformel für Benzol C6H6.
Eine für die chemische Welt wichtige Entdeckung macht Faraday 1825: Das Benzol. Er gewinnt es aus den flüssigen Rückständen des Walöls, das zur Beleuchtung in Londoner Straßenlaternen verbrannt wird. Benzol wird zum Inbegriff der Aromaten (das sind ungesättigte Verbindungen), und seine chemische Grundstruktur bildet die Basis einer großen Fülle von organischen Verbindungen. Die Erklärung der Struktur und damit zusammenhängend der chemischen Eigenschaften gelingt erst August Kekulé 1865: Es ist ein Ring aus sechs Kohlenstoffatomen, in dem alternierend Einfach- und Doppelbindungen vorkommen. Bis heute ist Benzol im Normal- und Superbenzin enthalten. Es ist also eine chemische Verbindung, die sowohl das Verständnis von Chemie geprägt hat als auch von großer wirtschaftlicher Relevanz ist.
Erst 1831 kommt Faraday wieder dazu, sich der Elektrizitätsforschung zu widmen. Schon seit Jahren plant er einen Versuch, der Magnetismus in Elektrizität umwandeln soll, was aber immer wieder misslingt. Aber dann umwickelt er einen Weicheisenring auf der einen Seite mit einer engeren, auf der anderen Seite mit einer weiteren Wicklung aus isoliertem Kupferdraht und legt auf der einen Seite eine Wechselspannung an. Was passiert? Nicht nur beim Einschalten des Stromflusses in der Wicklung, sondern auch beim Ausschalten schlägt eine magnetische Nadel aus: Faraday hat die elektromagnetische Induktion entdeckt, Grundvoraussetzung für den elektrischen Transformator und alle rotierenden elektrischen Maschinen.
Diese Stromstöße treten aufgrund der raschen zeitlichen Änderung des von der zweiten Schleife umfassten magnetischen Flusses auf. Bis heute ist Faradays Entdeckung der elektromagnetischen Induktion einer der Grundpfeiler der elektrischen Energietechnik.
1833 stiftet der exzentrische Mäzen John Fuller die Fuller-Professur für Chemie an der Royal Institution, die mit Michael Faraday besetzt wird. Außerdem bekleidet Faraday zwischen 1830 und 1852 den Lehrstuhl für Chemie an der Royal Military Academy in Woolwich und ist von 1836 bis kurz vor seinem Tod wissenschaftlicher Berater des Trinity House, das für den Bau von Leuchttürmen und Feuerschiffen in ganz England zuständig ist. Die Lampen sollen ein besseres Glas erhalten, durch das das Licht möglichst weit und gebrochen in alle Richtungen strahlt, und sie sollen elektrifiziert werden. Faraday ist auch verschiedentlich als Sachverständiger tätig und wird gemeinsam mit Charles Lyell beauftragt, die Ursache für ein Grubenunglück in Durham zu untersuchen, das sich 1844 ereignet hat.
Neben der Entdeckung des Benzols und der elektromagnetischen Induktion gehen noch weitere wesentliche Entdeckungen auf Michael Faraday zurück und sind auch mit seinem Namen bezeichnet. Allgemein bekannt ist der Faradaysche Käfig, in dem man nicht vom Blitz erschlagen werden kann. Der Grund ist, dass sich die Elektronen des Blitzes nur auf der Außenseite des Metallgehäuses ablagern. Der Innenraum einer geschlossenen Hülle aus leitfähigem Material ist von elektrostatischen Feldeinflüssen von außen völlig abgeschirmt. Dies macht man sich zum Schutze von elektronischen Bauteilen und hochsensiblen Messgeräten zunutze.
Die Faraday-Gesetze sind Grundgesetze der Elektrolyse und stellen den Zusammenhang zwischen der während der Elektrolyse abgeschiedenen Stoffmenge und der dabei freigesetzten Ladung her. Die elektrische Ladung pro Stoffmenge bei der Elektrolyse wird als Faraday-Konstante bezeichnet und ist eine Natur-Konstante. Von Faraday stammen auch alle Bezeichnungen für die Bestandteile des Elektrolyseverfahrens wie Anode, Kathode oder Elektrolyt. Die Faraday-Gesetze sind wichtig für die Berechnung der Schichtdicke bei der Galvanotechnik.
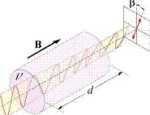
Farad-Effekt: Der Winkel der Lichtwelle wird durch das Magnetfeld leicht abgelenkt.
Durch Anwendung sehr starker Magneten entdeckt Faraday 1845, inspiriert durch ein Zusammentreffen mit dem späteren Lord Kelvin, dass Magnetismus nicht nur auf Eisenmetalle, sondern auf alle Materialien wirkt, und zwar entweder anziehend, also paramagnetisch, oder abstoßend, nämlich diamagnetisch. Der Diamagnetismus wirkt am stärksten bei Wismut. Der magneto-optische Faraday-Effekt, den Faraday im selben Jahr experimentell nachweisen kann, beschreibt den Zusammenhang von Licht und Magnetismus, und zwar einige Jahre vor dem mathematischen Beweis durch James Clerk Maxwell.
Inzwischen ist Faraday, der unstudierte, bereits zu einem der wichtigsten Wissenschaftler des Landes geworden und erhält 1832 den Ehrendoktor der Oxforder Universität, je zwei Mal die Royal Medal und die Copley Medal und wird 1836 Mitglied des Senats der Londoner Universität, später Mitglied der französischen Académie des Sciences und erhält den preußischen Orden pour le Mérite. Doch scheint er sich zu übernehmen - 1839 erleidet er wegen Überarbeitung einen gröberen Zusammenbruch und kann erst Jahre später wieder mit vollem Einsatz arbeiten. Neuen Auftrieb gibt ihm, dass William Thomson ihm schreibt, er habe inzwischen seine Theorie eines elektrischen Feldes, das er experimentell nie in den Griff bekam, mathematisch beschrieben. Und James Clerk Maxwell tut ähnliches, doch beginnen ab Mitte der 1850er Jahre die geistigen Kräfte von Faraday, der schon immer unter einer schwachen Merkfähigkeit leidet und daher sein Leben lang Notizen macht, um nicht bereits Beobachtetes oder Gedachtes zu vergessen, so deutlich nachzulassen, dass er die Theorien von Maxwell nicht mehr erfassen kann.
Faraday, der von seinen Biographen als „mathematischer Analphabet“ charakterisiert wird und der bei seinem gesamten wissenschaftlichen Werk ohne eine einzige mathematische Formel auskommt, erarbeitet alle seine Beiträge zur Elektrizität auf experimentellem Wege. Ohne die von ihm erkannten Gesetze hätte Maxwell nie seine mathematischen Theorien über Elektrizität und Magnetismus formulieren können, wie er selbst mehrmals betont.
Zweimal wird ihm die Würde des Präsidenten der Royal Society angeboten, die er zweimal ausschlägt. 1858 überlässt ihm Prinz Albert, der Gemahl von Queen Victoria, in Hampton Court für seine Verdienste ein kleines Anwesen auf Lebenszeit, wo er am 25. August 1867 geistig verwirrt stirbt.
Von Michael Faraday, dem Kind ohne fundierte Schulbildung, stammt die Idee der Weihnachtsvorlesungen (Christmas Lectures for juveniles), die vor allem für ein junges Publikum gedacht ist, um diesem naturwissenschaftliche Phänomene anschaulich darzubringen. Diese Weihnachtsvorlesungen erfreuen sich seit ihrer Gründung im Jahre 1826 der größten Popularität und werden – ausgenommen nur die ersten vier Jahre des Zweiten Weltkriegs – seither bis heute ununterbrochen durchgeführt. Seit 1966 werden sie von der BBC landesweit im Fernsehen übertragen, und für viele Briten gehören sie zu Weihnachten wie der Truthahnbraten. Faraday hat selbst neunzehn je sechsteilige Adventzyklen dieser Festvorträge gehalten, den ersten 1827, den letzten 1860. Die beiden letzten, über die verschiedenen Kräfte der Materie und über die chemische Geschichte einer Kerze, sind Klassiker und bis heute im gut sortierten Buchhandel zu finden. Auch die bis heute andauernden Freitagabendvorträge, nur im Rahmen der Institution und von Mitgliedern für Mitglieder gedacht, gehen auf seine Initiative zurück.

Weihnachtsvorlesung von Faraday
1931 wurde die Royal Albert Hall gemietet, um dort eine 14tägige Ausstellung zur 100Jahrfeier der Entdeckung der elektromagnetischen Induktion zu machen, die Faraday und seinen Auswirkungen auf die heutige Zeit gewidmet war. Zwischen 1991 und 2001 war Faraday auf der 20 Pfund Note abgebildet. Zwischen 1905 und 1998 war die Zeitschrift Journal of the Chemical Society nach ihm Faraday Transactions genannt. Die Ehre einer Namenszeitschrift wird nur ganz wenigen Naturwissenschaftlern zuteil – wie beispielsweise Liebigs Annalen der Chemie.
Die SI-Einheit Farad ist nach Michael Faraday benannt und beschreibt die elektrische Kapazität als den Quotienten der Ladung von einem Coulomb durch die Spannung von einem Volt: Ein Kondensator hat dann eine Kapazität von einem Farad, wenn er binnen einer Sekunde durch einen Strom von einem Ampere auf eine Spannung von einem Volt aufgeladen wird.
